
13 Aralık 2021 (22 Aralık 2021’de güncellenmiştir.)
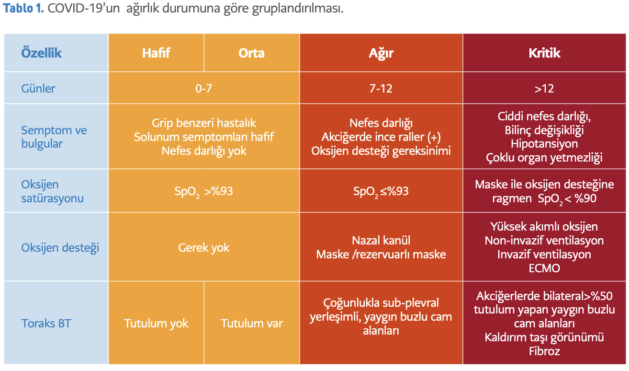
COVID-19 patogenezinde erken dönemde virusun, sonrasındaysa konak savunmasının rol aldığı bilinmektedir. Bu nedenle günümüzde COVID-19 tedavisinde hastalığın ilk 7-10 gününde virusun kendisi veya konak hücredeki çoğalma süreçleri; 7-10 günden sonraysa virusa karşı konağın verdiği dengesiz bağışık yanıt ve bunun sonucunda gelişen hiperinflamasyon ve koagülasyon sistemlerini hedefleyen ajanlar kullanılmaktadır. Anti-viral tedavilerin COVID-19’un erken döneminde, yani hastalığın henüz hafif-orta semptomlarla seyrettiği evrede etkili olması beklenmektedir (Tablo1).
Virusun kendisini veya konak hücresinde çoğalmasını inhibe etmek amacıyla çalışılmış veya halen çalışması devam eden çok sayıda ilaç bulunmaktadır. Virus ve virusun hücrede çoğalma süreci daha iyi anlaşıldıkça etkili olabilecek başka ilaç çalışmaları da gündeme gelmektedir. Bu ilaçlar esas olarak SARS-CoV-2 proteinlerini hedefleyenler ve SARS-CoV-2’nin konak hücresinde çoğalmasına yardım eden konak proteinlerini hedefleyenler olarak iki gruba ayrılabilir.
Burada SARS-CoV-2’yi hedefleyen tedaviler içinde yer alan, SARS-CoV-2’nin spike proteinini hedefleyen konvalesan plazma ve monoklonal antikorlar, SARS-CoV-2’nin RNA’ya bağımlı RNA polimerazını hedefleyen favipiravir, remdesivir ve molnupiravir ve SARS-CoV-2’nin ana proteazını hedefleyen pakslovid’in (PF- 07321332) COVID-19’daki etkinliği konusundaki güncel gelişmeler özetlenerek, mevcut kanıtlarla önerilerde bulunulacaktır (Tablo 2).
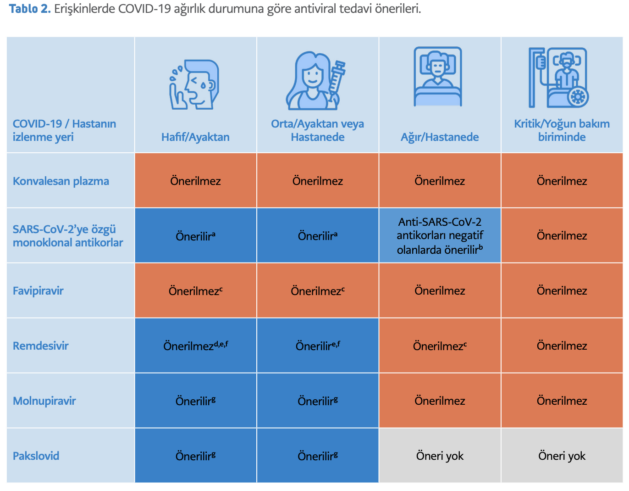
a: Ağır hastalık açısından risk faktörü bulunan ve semptom süresi 10 günden kısa olan hastalara önerilir.
b: Bağışıklığı baskılanmış hastalarda semptom süresine bakılmaksızın, bağışıklığı baskılanmamışlarda semptomların ilk 10 gününde kullanılabilir. Temin güçlüğü söz konusu olduğunda riskli gruplarda, metinde belirtilen sırada önceliklendirilerek kullanılabilir.
c: Sadece farklı doz seçeneklerini de içeren, iyi tasarlanmış klinik araştırmalar kapsamında kullanılabilir. Gebelerde kullanılmaz.
d: Damar içi yoldan verildiği için hastaneye yatırılmış hafif seyirli hastalarda kullanılabilir.
e: Gebelerde kullanımı konusunda yeterli veri yoktur, beklenen yararı fazlaysa hekim kararıyla kullanılabilir.
f: Ağır hastalık açısından risk faktörü olan ve semptom süresi 7 günden kısa olan hastalara kullanılabilir.
g: Ağır hastalık açısından risk faktörü bulunan ve semptom süresi 5 günden kısa olan hastalara önerilir. Gebe ve emzirenlerde kullanılmamalıdır.
Metinde geçen, “Ağır COVID-19 açısından risk yaratan durumlar ve hastalıklar” şunlardır:
- Yaşlılık (≥65 yaş)
- Gebelik
- Bağışıklığı baskılayan hastalık varlığı veya ilaç kullanımı
- Diabetes mellitus
- Obezite (VKİ >30kg/m2)
- Kronik böbrek yetmezliği
- Kronik karaciğer hastalığı (siroz)
- Hipertansiyon (pregestasyonel veya gestasyonel)
- Diğer kardiovasküler hastalıklar (konjenital kalp hastalıkları, kapak hst dahil)
- Kronik akciğer hastalıkları (örn. KOAH, orta-ağır şiddetli astım, kistik fibroz, interstisyel akciğer hastalığı, pulmoner hipertansiyon)
- Orak hücreli anemi
- Nörolojik gelişimsel hastalıklar (örn. serebral palsi)
- Down sendromu
- Diğer tıbbi kompleks durumları (örn. genetik veya metabolik sendromlar veya ağır konjental anomaliler)
- Medikal teknolojik destek alanlar (trakeostomi, gastrostomi, solunum desteği vb.)
Konvalesan Plazma
Toplam 11 782 hasta içeren on randomize kontrollü çalışmanın meta-analizinde, COVID-19’dan iyileşmiş hastalardan elde edilen konvalesan plazma uygulamasının, COVID-19 hastalarında mortalite (RR:1.02 , %95CI:0.92 -1.12), hastane yatış süresi (HR:1.07, %95CI:0.79 – 1.45), mekanik ventilasyon süresi (RR:0.81, %95CI:0.42 -1.58) üzerine olumlu bir etkisinin olmadığı görülmüştür (1). Ancak bir randomize kontrollü (2) ve bir gözlemsel çalışmada (3), yüksek anti-SARS-CoV-2 S antikoru olan donörden, ilk 3-5 günde verilmesi halinde konvalesan plazma tedavisinin etkili olabileceğine dair veriler elde edilmesiyle, bu konuda ek çalışmaların gerektiği düşünülmüştür. Bunu izleyen süreçte ağır COVID-19 riski olan, >50 yaş, ayaktan izlenen 511 COVID-19 hastasında yapılan randomize, plasebo kontrollü bir çalışmada, erken dönemde (semptom süresi ortalama 4 gün), yüksek antikor titreli konvalesan plazma (ortalama nötralizan antikor titresi 1/641) kullanımının, hastalığın ilerlemesi anlamında bir fark yaratmadığı (%30’a karşılık %31.9) görülmüştür (4). Bu verilerle DSÖ, COVD-19 tedavisi amacıyla konvalesan plazma kullanılmamasını önermiştir (5).
Öneri
Yapılan çok sayıda randomize kontrollü çalışmada COVID-19 tedavisinde konvalesan plazma tedavisinin, erken dönemde ve yüksek antikor titresi içeren plazma uygulaması dahil olmak üzere, etkisiz olduğu görülmüştür. Bu nedenle COVID-19 tedavisi amacıyla konvalesan plazma kullanımı önerilmemektedir.
Kaynaklar
- Janiaud P, Axfors C, Schmitt AM, Gloy V, Ebrahimi F, Hepprich M, et al. Association of Convalescent Plasma Treatment With Clinical Outcomes in Patients With COVID-19: A Systematic Review and Meta-analysis. JAMA. 2021;325(12):1185-1195. doi: 10.1001/jama.2021.2747. PMID: 33635310; PMCID: PMC7911095.
- Libster R, Pérez Marc G, Wappner D, Coviello S, Bianchi A, Braem V, et al. Early High-Titer Plasma Therapy to Prevent Severe Covid-19 in Older Adults. N Engl J Med. 2021;384(7):610-618. doi: 10.1056/NEJMoa2033700. Epub 2021 Jan 6. PMID: 33406353; PMCID: PMC7793608.
- Joyner MJ, Carter RE, Senefeld JW, Klassen SA, Mills JR, Johnson PW, et al. Convalescent Plasma Antibody Levels and the Risk of Death from Covid-19. N Engl J Med. 2021;384(11):1015-1027. doi: 10.1056/NEJMoa2031893. Epub 2021 Jan 13. PMID: 33523609; PMCID: PMC7821984.
- Korley FK, Durkalski-Mauldin V, Yeatts SD, Schulman K, Davenport RD, Dumont LJ, El Kassar N, et al. Early Convalescent Plasma for High-Risk Outpatients with Covid-19. N Engl J Med. 2021;385(21):1951-1960. doi: 10.1056/NEJMoa2103784. Epub 2021 Aug 18. PMID: 34407339; PMCID: PMC8385553.
- Therapeutics and COVID-19 WHO Living guideline; https://www.who.int/publications/i/item/WHO-2019-nCoV-therapeutics-2021.4
SARS-CoV-2’ye özgü monoklonal antikorlar
Bu ajanlarla, çok sayıda hasta içeren, randomize çift-kör plasebo kontrollü, genel olarak erişkinlerde yapılan çalışmalarda şu sonuçlar elde edilmiştir :
Ayaktan izlenen hastaların tedavisinde: Hastalığının ilk 7-10 gününde olan ve ağır hastalık için risk faktörü bulunan COVID-19 hastalarında İV yoldan uygulanan bamlavinimab/etesevimab, kasirivimab/imdevimab (subkutan da uygulanabşlmektedir), sotrovimab, regdenvimab ve BRII-196/BRII-198 isimli SARS-CoV-2’ye özgü monoklonal antikorların ölüm ve hastane yatışını >%70-85 azalttığı gösterilmiştir (1-6). Ayaktan izlenen, %90’ı ağır hastalık için riskli, hafif/orta seyirli semptomatik COVID-19 hastalarının tedavisinde de intramuskuler yoldan verilen tiksagevimab/silgavimabın hastane yatışı ve ölümü, semptomların ilk 5 gününde verildiğinde %67, ilk 7 günde verildiğindeyse %50 oranında azalttığı gösterilmiştir (7).
Hastanede yatan hastaların tedavisinde: Oksijen almayan veya düşük akımda alan ve seronegatif olan COVID-19 hastalarında kasirivimab-imdevimabın ölüm-mekanik ventilasyonu %47 azalttığı gösterilmiştir (8).
Temas sonrası profilakside: Ev içi temastan sonraki ilk 96 saatte başvuranlarda subkutan uygulanan kasirivimab-imdevimabın semptomatik hastalığı %92 azalttığı gösterilmiştir (9).
Temas öncesi profilakside: SARS-CoV-2 geçirmemiş, aşısız, aşı yanıtının yetersiz olma riski veya SARS-CoV-2 temas riski yüksek erişkinlerde intramusküler uygulanan, uzun etkili tiksagevimab–silgavimab kombinasyonunun ilk 6 ayda SARS-CoV-2 RT-PCR-pozitif semptomatik hastalığı %77 azalttığı gösterilmiştir (10).
COVID-19 tedavisi için kanıta dayalı öneriler sunan ABD NIH, IDSA ve ESCMID rehberleri’nde hafif-orta seyirli COVID-19 nedeniyle ayaktan izlenen ve ağır hastalığa ilerleme riski yüksek olan hastalarda bamlavinimab/etesevimab, kasirivimab/imdevimab veya sotrovimab tedavileri önerilmektedir. Yine yatan, ağır hastalık riski bulunan seronegatif hastalara kasirivimab-imdevimab önerilmiştir (11-14). Ağır hastalığa ilerleme riski yüksek olan gruplar içinde ileri yaş (≥65), obezite (erişkinde BMI >25 kg/m2, 12-17 yaş arasında BMI’nin yaş ve cinse göre≥ 85. persantil olması), kronik böbrek yetmezliği, diabetes mellitus, bağışıklığı baskılayan hastalık varlığı veya ilaç kullanımı, kardiovasküler hastalıklar (konjenital kalp hastalıkları veya hipertansiyon dahil), kronik akciğer hastalıkları (örn. KOAH, orta-ağır şiddetli astım, kistik fibroz, interstisyel akciğer hastalığı, pulmoner hipertansiyon), nörolojik gelişimsel hastalıklar (örn.serebral palsi), orak hücreli anemi, diğer tıbbi kompleks durumlar (örn.genetik veya metabolik sendromlar veya ağır konjental anomaliler) ile birlikte gebelik de yer almıştır (12). Monoklonal antikor uygulamasının yararını gösteren klinik çalışmalarda tam temsil edilmemiş olsalar da ağır hastalık açısından risk grubunda bulunmaları nedeniyle gebelerde mAb tedavisine ABD FDA tarafından acil kullanım onayı verilmiştir. Bu ajanların, şu ana kadar kullanılmış olduğu gebelerdeki sonuçlarına bakılarak da, gebelerde etkili ve güvenli olduğu söylenebilir (16).
Onay almış veya geliştirilmekte olan tüm mAb’lar, S proteinin ACE-2 reseptörüne bağlanan Reseptör Bağlayan Bölgesini (RBD) hedeflemektedir. Bu nedenle virusun RBD’sinde gelişen mutasyonlar mAb’ların etkisini azaltabilir. Pandeminin başından beri bağışıklıktan kaçabilen SARS-CoV-2 varyantları ortaya çıkmaktadır ve infeksiyon zinciri kırılmadıkça çıkmaya da devam edecektir. Bu durumun mAb tedavileri üzerine olumsuz etkisi olabilir. Bu nedenle bir ülkede veya bölgede kullanılacak mAb’lara karar verilirken, o bölgede yaygın olan varyantların duyarlılığının da dikkate alınması önerilmektedir. Aynı nedenle RBD’nin mutasyona kolay uğrayan bölgerine karşı geliştirilen mAb’lar tek başlarına değil ikili kombinasyonlar halinde kullanılmaktadır. Nitekim artmış varyant direnci nedeniyle tek başına bamlanivimab uyulamasının acil kullanım onayı Nisan 2021’de geri çekilmiştir. Bununla birlikte sotrovimab gibi bazı mAb’lar mutasyondan korunmuş bölgeleri hedef almaları nedeniyle mevcut VOC/VOI’lere in vitro ve in vivo olarak etkilerini korumaktadırlar. Bu tür mAb’ların kombinasyon halinde kullanılmasına da gerek olmadığı bildirilmektedir. Ancak her durumda kullanımdaki mAb’lara karşı dolaşımdaki varyantlarda direnç gelişimi yakından izlenmelidir (17).
Var olan mAb’lar içinde ülkemizde şu anda baskın olan deltaya karşı etkinliğini devam ettirenler bamlavinimab/etesevimab, kasirivimab/imdevimab, sotrovimab ve tiksagevimab /silgavimabdır (18). Ancak yeni ortaya çıkan omikron varyantının, mAb’lardan kaçabileceği kaygısı bulunmaktadır ve özellikle bamlavinimab/etesevimab, kasirivimab/imdevimabın etkinliğinin ciddi şekilde azalabileceği tahmin edilmekte, sotrovimabın ise etkinliğinin devam edeceği öngörülmektedir.
Monoklonal antikorların en önemli dezavantajları genellikle İV (bazılarının İM veya SC) uygulanması, fiyatlarının çok yüksek olması ve dünyada COVID-19’un halen çok fazla görülüyor olması nedeniyle üretici firmaların ürünleri yeterli miktarda ve hemen sağlayamamasıdır. Ülkemizde henüz bulunmayan ve kullanılamayan bu SARS-CoV-2’ye mAb’lara ulaşılabilmesi, özellikle riskli gruplarda ölüm oranlarının azaltılmasına katkı sağlayacaktır.
Öneri
Ayaktan izlenen veya başka nedenlerle hastanede yatarken orta-hafif seyirli doğrulanmış COVID-19 tanısı konulan, SARS-CoV-2’ye karşı TAM AŞILAMASI YAPILMAMIŞ kişilerde, semptomların başlamasından itibaren İLK 10 GÜN İÇİNDE, aşağıda tanımlanmış RİSK FAKTÖRLERİNDEN EN AZ BİRİNİN OLMASI HALİNDE bamlanivimab/etesevimab, kasirivimab/imdevimab, sotrovimab ve onay alması halinde tiksagevimab /silgavimab tedavilerinden birinin uygulanması önerilir. Kaynakların sınırlı olması halinde aşağıdaki grupların sırayla önceliklendirilmesi önerilir. FDA, 3 Aralık itibariyle bebekler dahil olmak üzere tüm yaş gruplarında kasirivimab/imdevimab kullanımını onaylamış olmakla birlikte 18 yaş altında olan yüksek riskli hastalarda mAb’ların etkinliği konusunda sınırlı veri vardır.
- Gebelik
- Bağışıklığı baskılanmış ve aşıyla Anti-SARS-CoV-2 antikoru oluşmadığı gösterilen hastalar (bu hastalarda ilk 10 gün koşulu aranmaz)
- Bağışıklığı baskılayan hastalık varlığı veya ilaç kullanımı
- Yaş ≥65
- Diğer komorbiditeleri olanlar
- Diabetes mellitus
- Obezite (BMI >30kg/m2)
- Kronik böbrek yetmezliği
- Hipertansiyon (pregestasyonel veya gestasyonel)
- Diğer kardiovasküler hastalıklar (konjenital kalp hastalıkları, kapak hst. dahil)
- Kronik akciğer hastalıkları (örn.KOAH, orta-ağır şiddetli astım, kistik fibroz, interstisyel akciğer hastalığı, pulmoner hipertansiyon)
- Orak hücreli anemi
- Nörolojik gelişimsel hastalıklar (örn.serebral palsi)
- Diğer tıbbi kompleks durumları (örn.genetik veya metabolik sendromlar veya ağır konjental anomaliler)
Kaynaklar
- Chen P, Nirula A, Heller B, Gottlieb RL, Boscia J, et al. SARS-CoV-2 Neutralizing Antibody LY-CoV555 in Outpatients with Covid-19. New England Journal of Medicine 2021;384(3):229-237. doi: 10.1056/NEJMoa2029849.
- Investor/Lilly. Lilly’s bamlanivimab and etesevimab together reduced hospitalizations and death in Phase 3 trial for early COVID-19 Website https://investor.lilly.com/news-releases/news-release-details/lillys-bamlanivimab-and-etesevimab-together-reduced [accessed 16 June 2021].
- Weinreich DM, Sivapalasingam S, Norton T, Ali S, Gao H, et al. REGN-COV2, a Neutralizing Antibody Cocktail, in Outpatients with Covid-19. New England Journal of Medicine 2021;384(3):238-251. doi: 10.1056/NEJMoa2035002.
- Gupta A, Gonzalez-Rojas Y, Juarez E, Casal MC, Moya J, at al. Covid-19 Treatment With SARS-CoV-2 Neutralizing Antibody Sotrovimab. medRxiv preprint 2021; doi: https://doi.org/10.1101/2021.05.27.21257096[accessed 16 June 2021].
- Ison MG. Therapeutic effect of regdanvimab in patients with mild to moderate COVID-19: Day 28 results of a multicenter, randomized, controlled, pivotal trial. IDWeek 2021 Poster Session; September 29 –October 3, 2021.
- O’Brien MP, Forleo-Neto E, Sarkar N, Isa F, Hou P, Chan KC, et al. Subcutaneous REGEN-COV Antibody Combination in Early SARS-CoV-2 Infection. medRxiv [Preprint]. 2021:2021.06.14.21258569. doi: 10.1101/2021.06.14.21258569. PMID: 34159343; PMCID: PMC8219113.
- https://www.astrazeneca.com/media-centre/press-releases/2021/azd7442-phiii-trial-positive-in-covid-outpatients.html
- RECOVERY Collaborative Group. Casirivimab and imdevimab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. medRxiv preprint 2021; doi: https://doi.org/10.1101/2021.06.15.21258542. [accessed 16 June 2021].
- O’Brien MP, Forleo-Neto E, Musser BJ, Isa F, Chan KC, Sarkar N, et al. Subcutaneous REGEN-COV Antibody Combination to Prevent Covid-19. N Engl J Med. 2021 ;385(13):1184-1195. doi: 10.1056/NEJMoa2109682. Epub 2021 Aug 4. PMID: 34347950; PMCID: PMC8362593.
- Levin MJ.Phase 3 study of efficacy and safety of AZD7442 for pre-exposure prophylaxis of COVID-19 in adults. IDWeek 2021 ; Late Breaker Abstract 5; September 29 –October 3, 2021
- COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. Available at https://www.covid19treatmentguidelines.nih.gov/ [accessed 16 September 2021]
- Bhimraj A, Morgan RL, Shumaker AH, Lavergne V, Baden L, et al. Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19. Infectious Diseases Society of America 2021; Version 4.3.0. Website https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management/. [accessed 16 June 2021]
- Bartoletti M, Azap O, Barac A, Bussini L, Ergonul O, Krause R, et al. ESCMID COVID-19 Living guidelines: drug treatment and clinical management. Clin Microbiol Infect. 2021:S1198-743X(21)00634-0. doi: 10.1016/j.cmi.2021.11.007. Epub ahead of print. PMID: 34823008; PMCID: PMC8606314.
- Therapeutics and COVID-19 WHO Living guideline; https://www.who.int/publications/i/item/WHO-2019-nCoV-therapeutics-2021.4
- https://www.fda.gov/media/145802/download
- Thilagar BP, Ghosh AK, Nguyen J, et Outcomes of Anti-Spike Monoclonal Antibody Therapy in Pregnant Women with Mild to Moderate COVID-19. medRxiv 2021.11.27.21266942; doi: https://doi.org/10.1101/2021.11.27.2126694
- Corti D, Purcell LA, Snell G, Veesler D. Tackling COVID-19 with neutralizing monoclonal antibodies. Cell 2021;184(12):3086-3108. doi: 10.1016/j.cell.2021.05.005
- https://covdb.stanford.edu/page/susceptibility-data/
Favipiravir
Favipiravirin COVID-19’da etkinliğini araştıran ve karşılaştırma grubu olan 9 klinik çalışmanın (8’i randomize kontrollü) meta-analizinde, favipiravir grubunda 7.günde klinik iyileşmenin belirgin olarak daha fazla (RR:1.24, 95%CI: 1.09-1.41; P=0.001) olduğu görülmüş; istatistiksel olarak anlamlı olmamakla birlikte 14.gündeki viral klirens oranlarının daha yüksek (RR:1.11, %95CI: 0.98-1.25; P=0.094); oksijen gereksiniminin %7 daha az (RR:0.93, %95CI: 0.67-1.28; P=0.664) ve mortalitenin %30 daha düşük (RR:0.709, %95CI: 0.262-1.920, P=0.499) olduğu belirlenmiştir (1). Kısa süre önce yayımlanmış ve karşılaştırma grubu olan 12 çalışmanın dahil edildiği bir diğer meta-analiz çalışmasında da COVID-19 hastalarında favipiravirin ölümü ve mekanik ventilasyon gereksinimini azaltmadığı görülmüştür (2).
Ancak her iki meta-analize dahil edilen çalışmaların tasarımları, çalışmada karşılaştırılan ajanlar oldukça farklıdır, randomize çalışmalar açık etiketlidir ve plasebo kontrollü değildir, çalışmalara alınmış hasta grupları da heterojendir, tüm bu nedenlerle favipiravirin COVID-19 tedavisindeki yerinin belirlenmesini sağlamak üzere çift kör, randomize, plasebo kontrollü çalışmalar gerekmektedir.
Yukarıda belirtilmiş çalışmalara ek olarak Japonya’da üretici firmanın yaptığı plasebo kontrollü, tek kör Faz-3 çalışmasında ağır olmayan pnömonili 156 COVID-19 olgusunda SARS-CoV-2 viral klirensi, favipiravir grubu için 11.9 günken, placebo grubu için 14.7 olarak belirlenmiş ve aradaki fark istatistiksel olarak anlamlı bulunmuştur (P = 0.013) (3). Ancak bu sonuçları Aralık 2020’de değerlendiren Japon İlaç ve Tıbbi Cihaz Kurumu (PMDA), ek değerlendirmelere gereksinim olduğunu bildirerek favipiravirn Japonya’da COVID-19 tedavisinde kullanımına onay vermemiştir. Onay vermeme nedenleri olarak; bu Faz-3 çalışmasının sonlanım noktası olan “semptomların iyileşmesi” nin değerlendirilmesinin subjektiviteden etkilenme potansiyeli taşıması, tasarımının tek-kör olması ve gruplar arasında yanlılığın etkinliği göstermek açısından çok sorunlu olmasını belirtmişlerdir. Kurul, ülkede yapılan klinik çalışmanın verilerinin yetersiz olması nedeniyle Kuveyt ve ABD’de devam eden klinik çalışmaların sonuçlarına göre onayın tekrar değerlendirilmesini uygun bulmuştur (4). Kuveyt’te devam eden çift-kör faz-3 çalışmanın 353 hastayı içeren ve 27 Ocak 2021’de yapılan ara analizinde, favipiravir ve plasebo grupları arasında primer sonlanım açısından (hipoksinin düzelme süresi) istatistiksel olarak anlamlı bir fark bulunmamış (7 vs. 8 gün, P > 0.05) ve çalışmanın bu nedenle sonlandırıldığı duyurulmuştur. Bu çalışmanın, 181 ağır olmayan hastayı (başvuruda NEWS skoru düşük olan) içeren alt grup analizlerinde favipiravir verilenlerde taburculuk süresi 8 günken, plasebo grubunda 11 gün olduğu (P=0.006) görülerek, favipiravirin COVID-19 hastalarında erken başlanmasının yararlı olacağı ve geç evrelerde başlandığında etkili olmayacağı hipotezinin desteklendiği bildirilmiştir (5).
Favipirivirin COVID-19’daki etkinliğini araştıran yukarıda özetlenmiş çalışmalara göre çok daha güçlü kanıtlar sağlayacak olan ve Apiili Therapeutics sponsorluğunda ABD, Meksika ve Brezilya’da yürütülen PRESECO çalışmasının sonuçları 12 Kasım 2021 tarihinde açıklanmıştır (6): Bu çalışma. favipiravirin, ayaktan hafif-orta COVID-19 hastalarında etkinliğini araştıran randomize, çift kör, plasebo kontrollü bir faz-3 çalışması olup, çalışmaya dahil edilen 1231 hastada favipiravirin klinik iyileşme süresi üzerine anlamlı bir etkisinin olmadığı bildirilmiştir.
Kısa süre önce yayımlanmış açık etiketli, bir diğer randomize klinik çalışmada da, Malezya’da 14 hastanede izlenmiş ≥50 yaş, ≥1 komorbiditesi olan ve hastalığının ilk 7 gününde hastaneye yatırılmış 500 hafif/orta (oksijen almayan hastalar) COVID-19 hastasında hipoksik olma, mekanik ventilasyon veya YBÜ’ye gereksinim duyma ve ölüm oranları, favipiravir alan ve almayan hastalar arasında farklı bulunmamıştır (7).
Son olarak favipiravir ayaktan izlenen, ağır hastalık riski bulunan kişilerdeki COVID-19’un tedavisinde, PRINCIPLE (The Platform Randomised trial of Interventions Against COVID-19 In Older People) çalışmasının bir kolu olarak denenmektedir. Bu çalışmanın sonuçlarının yıl sonuna kadar açıklanması beklenmektedir (8).
Öneri
Kısa süre önce sonuçları açıklanmış ve yayımlanmış randomize kontrollü çalışmaların sonuçlarıyla birlikte, favipiravirin COVID-19’da ölümü ve hastane yatışını azaltma gibi önemli klinik sonuçlara istenen etkinliğinin olmadığı görülmüştür. Bu nedenle COVID-19 tedavisinde favipiravir rutin olarak kullanılmamalı, sadece farklı doz seçeneklerini de içeren, iyi tasarlanmış klinik araştırmalar kapsamında kullanılmalıdır.
Kaynaklar
- Hassanipour S, Arab-Zozani M, Amani B, Heidarzad F, Fathalipour M, et al. The efficacy and safety of Favipiravir in treatment of COVID-19: a systematic review and meta-analysis of clinical trials. Scientific Reports 2021;11:11022. doi: 10.1038/s41598-021-90551-6.
- Özlüşen, B., Kozan, Ş., Akcan, R.E. et al. Effectiveness of favipiravir in COVID-19: a live systematic review. Eur J Clin Microbiol Infect Dis 40, 2575–2583 (2021). https://doi.org/10.1007/s10096-021-04307-1.
- FUJIFILM Toyama Chemical Co., Ltd. Anti- influenza drug Avigan® tablet meets primary endpoint in phase III clinical trial in Japan for COVID- 19 patients. , June 5, 2021. Website https://www.com/jp/en/news/hq/5451?_ga=2.10224 8257.19488 31102.1612073055 – 48278 478.16120 73055. [accessed 16 June 2021].
- Ueda M, Tanimoto T, Murayama A, Ozaki A, Kami M. Japan’s Drug Regulation During the COVID-19 Pandemic: Lessons From a Case Study of Favipiravir. Clinical Pharmacological Therapy 2021. doi: 10.1002/cpt.2251.
- Reddy’s and GRA announce Avigan Pivotal Studies Update Study for hospitalized moderate to severe cases in Kuwait terminated, while study for out-patient mild to moderate cases continues in North America. June 5, 2021 . Website https://www.drreddys.com/media/928938/2021-01-avigan-trial-update_v1.pdf. [accessed 16 June 2021].
- https://www.appilitherapeutics.com/newsfeed/Appili-Therapeutics-Provides-Update-on-Phase-3-PRESECO-Clinical-Trial-Evaluating-Avigan%C2%AE%2FReeqonus%E2%84%A2 . [accessed 11 Dec 2021].
- Chuan Huan Chuah, Ting Soo Chow, Chee Peng Hor, Joo Thye Cheng, Hong Bee Ker, Heng Gee Lee, Kok Soon Lee, Noridah Nordin, Tiang Koi Ng, Masliza Zaid, Nor Zaila Zaidan, Suhaila Abdul Wahab, Nurul Ashikin Adnan, Noorlina Nordin, Tze Yuan Tee, Su Miin Ong, Suresh Kumar Chidambaram, Mahiran Mustafa, Malaysian Favipiravir Study Group, Efficacy of Early Treatment with Favipiravir on Disease Progression among High Risk COVID-19 Patients: A Randomized, Open-Label Clinical Trial, Clinical Infectious Diseases, 2021; ciab962, https://doi.org/10.1093/cid/ciab962
- Favipiravir to be investigated as a possible COVID-19 treatment for at-home recovery in the PRINCIPLE trial. 8 April 2021. Website https://www.principletrial.org/news/favipiravir-to-be-investigated-as-a-possible-covid-19-treatment-for-at-home-recovery-in-the-principle-trial. [accessed 16 June 2021].
Remdesivir
Remdesivirin COVID-19 tedavisinde etkinliğini araştıran, 7333 hasta verisini içeren 4 randomize kontrollü çalışmanın meta-analizinde, bu ilacın hastalarda mortaliteyi ve mekanik ventilasyon gereksinimini azaltmadığı ve klinik iyileşmeyi hızlandırmadığı sonucuna ulaşılmıştır (1). Ancak mevcut verilerin kesin bir sonuca varabilmek için yeterli olmadığı da belirtilmiştir. Bu nedenlerle remdesivirin COVID-19’daki kullanımı konusunda da bir uzlaşıya varılamamış, DSÖ hastaneye yatan hastalarda remdesivir kullanımını önermezken, ABD IDSA ve NIH rehberleri oksijen ihtiyacı olup, mekanik ventilasyon desteği gerekmeyen yatan hastalarda 5 günlük IV remdesivir tedavisi önermektedir (2, 3). Aslında IDSA’nın analizlerinde de remdesivirin hastaların 28. Günündeki klinik iyileşme ve mortalite oranları (RR:0.92; %95CI: 0.77-1.10) üzerine önemli bir etkisinin olmadığı gözlenmiş olmakla birlikte, remdesivir alan hastalarda 28.günde klinik iyileşmenin daha fazla olma eğiliminde olduğu (RR:1.13; % 95CI 0.91-1.41) ve ek olarak ağır COVID-19’lu hastaların post-hoc analizinde remdesivir alan hastalarda ortalama iyileşme süresinin kısaldığı (ortanca 11’e karşılık 18 gün; RR:1.31; 95%CI: 1.12-1.52) ve mekanik ventilasyona daha az gereksinim duydukları (RR: 0.57; 95%CI: 0.42-0.79) görülmüştür (3).
Remdesivir İV yolla uygulandığı için, yukarıda sözü edilen çalışmaların hepsinde hastaneye yatırılan, dolayısıyla genellikle viral dönemi geçip, immunolojik dönemde bulunan ağır hastalarda denenmiştir. Oysa antiviral ilaçların, hastalığın erken dönemlerinde başlanması halinde etkili olması beklenmektedir. Bu nedenle ayaktan izlenen ve ağır COVID-19 gelişme riski olan 562 hastada, tedavinin hastalığın ilk 3 gününde başlandığı randomize kontrollü bir çalışmada, 28.günde ölüm veya hastaneye yatış oranı remdesivir verilenlerde %0.7 iken plasebo verilenlerde %5.3 (p=0.008) bulunmuştur. Bu umut vadeden verilerden sonra Gilead remdesivirin oral formunu geliştirmek üzere çalışmalara başlamıştır (4).
Öneri
Elde edilen veriler remdesivirin, COVID-19’da erken dönemde başlandığında etkili olabileceğini düşündürmektedir. Bu nedenle daha etkili olan monoklonal antikorlar veya ağızdan alınabilecek molnupiravir vb. ajanlara ulaşılamaması halinde ve semptomların ilk 7 gününde olan, ağır COVID-19 açısından risk faktörü bulunan kişilerde İV remdesivir kullanılması önerilir.
Kaynaklar
- WHO, Therapeutics and COVID-19: living guideline – World Health Organization (WHO), 31 March 2021. [accessed 16 June 2021].
- COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. Available at https://www.covid19treatmentguidelines.nih.gov/ [accessed 16 September 2021]
- Bhimraj A, Morgan RL, Shumaker AH, Lavergne V, Baden L, et al. Infectious Diseases Society of America Guidelines on the Treatment and Management of Patients with COVID-19. Infectious Diseases Society of America 2021; Version 4.3.0. Website https://www.idsociety.org/practice-guideline/covid-19-guideline-treatment-and-management/. [accessed 16 June 2021]
- Hill JA. Remdesivir for the treatment of high-risk non-hospitalized individuals with COVID-19: A randomized, double blind, placebo-controlled trial. IDWeek 2021 ; Late Breaker Abstract 1; September 29 –October 3, 2021
- Willyard C. Nature 2021; https://doi.org/10.1038/d41586-021-02783-1
- Gottlieb LG, Vaca CE, Paredes R, et al. Early Remdesivir to Prevent Progression to Severe Covid-19 in Outpatients. New England Journal of Medicine2021; DOI: 10.1056/NEJMoa2116846
Molnupiravir
Molnupiravir (MK-4482/EIDD-2801), nükleozid analoğu olan N4-hidroksisitidin (NHC)’in oral kullanılabilen bir ön ilacıdır. NHC’nin RNA viruslarına karşı geniş spektrumlu bir etkisi vardır ve in-vitro olarak Ebola virus, koronaviruslar, respiratuar sinsityum virusu (RSV) ve Venezuella at ensefaliti virusu (VEEV)’na karşı etkili olduğu gösterilmiştir. NHC varlığında farklı viruslarla yapılan seri pasajlarda, bu ajanın direnç bariyerinin yüksek olduğu görülmüştür. NHC, SARS-CoV-2’ye karşı Calu-3 ve insan hava yolları hücrelerinde yapılan testlerde oldukça etkili antiviral etkinlik göstermiş olup, IC50 değerleri sırasıyla 0.08 mM ve 0.024 mM olarak belirlenmiştir. Ek olarak MERS-CoV, SARS-CoV ve SARS’la ilişkili diğer zoonotik grup 2b ve 2c yarasa koronaviruslarına ve remdesivir direnç mutasyonu taşıyan koronaviruslara karşı da etkili olduğu gösterilmiştir. Anti-viral etkinliğinin esas olarak viral mutasyon sıklığında artışa yol açmasından kaynaklandığı bilinmektedir. Gerçekleşen çok sayıdaki mutasyon (mutasyon fırtınası) virusun çoğalamayacak ve bütünlüğünü koruyamayacak kadar değişmesine neden olmaktadır. İlacın konak hücre RNA’sında ise mutasyona yol açmadığı bildirilmiştir (1).
Molnupiravirin SARS-CoV-2 ile infekte farelerde hem profilaktik, hem de terapötik uygulanması etkili bulunmuş, akciğer fonksiyonlarını iyileştirdiği, akciğerdeki virus titrelerini düşürdüğü gösterilmiştir. Bu özellikleriyle gelecekte ortaya çıkabilecek zoonotik koronaviruslar için de alternatif olabileceği düşünülmektedir (2). Gelincik modelinde, günde 2 kez uygulanan molnupiravir tedavisi üst solunum yollarındaki SARS-CoV-2 viral yükünü belirgin olarak azaltmış ve tedavi almayan hayvanlara infeksiyon bulaşmasını engellemiştir. Bu çalışmada erken dönemde başlanan molnupiravirin daha etkili olabildiği görülmüştür (3).
Faz 1 klinik çalışmada molnupiravirin tek doz ve çok sayıda doz uygulanmasının sağlıklı gönüllülerde iyi tolere edildiği ve dozla orantılı bir farmakokinetiği olduğu gösterilmiş, Faz-2’de ideal doz olarak 2X800mg/gün, 5 gün süreyle uygulanmasının uygun olduğu sonucuna varılmıştır (4).
Molnupiravirin yatan (MOVeIN) ve ayaktan (MOVeOUT) hastalarda yürütülen faz II/III klinik çalışmalarının ara analizinde, yatan hastalarda herhangi olumlu bir etkisi görülmediği MOVeIN çalışması sonlandırılmış ve ayaktan hastalardaki MOVeOUT çalışmasına devam edilmesi kararlaştırılmıştır (5).
Hindistan’da hafif seyirli 741 COVID-19 olgusunda yapılmış bir diğer randomize kontrollü çalışmada, tek başına standard bakımla karşılaştırıldığında, ek olarak 800 mg X2/gün, 5 gün molnupiravir verilen hastalarda 5, 10 ve 14. günlerde daha yüksek oranda klinik iyileşme (sırasıyla %63 vs % 22; P<0.0001; %79 vs %49.5; P<0.0001; %81.5 vs %73.2; P=0.015) görülmüş ve klinik iyileşme süresi molnupiravir grubunda 8 günken kontrol grubunda 12 gün (P=0.0001) olarak belirlenmiştir. Bu çalışmada 5., 10. ve 14.günde SARS CoV-2 RT-PCR negatifliği molnupiravir grubunda belirgin olarak daha yüksek olmuş (P<0.0001), son olarak hastane başvurusu da molnupiravir grubunda %1.89, kontrol grubunda ise %6.22 olarak belirlenmiştir (P=0.0027) (6). Yine Hindistan’da yapılan bir başka çalışmada ise orta ağırlıktaki COVID-19 hastalarında etkisiz bulunduğu açıklanmıştır (7).
Ağır COVID-19 açısından risk grubunda olan, semptomlarının ilk 5 gününde olup ayaktan izlenen hastalarla devam edilen MOVe-OUT çalışmasına toplam 1850 hasta alınması planlanmaktaydı. Ancak 1 Ekim 2021’de sonuçları açıklanan ara analizde, 29 gün sonunda hastane yatış gerektirecek ağırlaşma ve ölüm oranının molnupiravirle tedavi edilen grupta %7.3 (28/385), plasebo grubunda ise %14.1 (53/377), (%50’lik azalma, P=0.0012) olduğunun görülmesi üzerine (8), bağımsız komite ve FDA çalışmanın erken sonlandırılmasını önermiştir.
Kasım 2021 tarihinde MOVe-OUT çalışmasına dahil edilmiş toplam 1433 hastanın son analiz sonuçları duyurulmuştur. Buna göre ayaktan, riskli hasta grubunda ölüm ve hastane yatışı oranının molnupiravir grubunda %6.8 (48/709), plasebo grubunda %9.7 olduğu, %3’lük mutlak risk azalması (%95CI: 0.1-5.9; nominal P=0.0218) gözlendiği, relatif risk azalmasınınsa %30 (RR: 0.70; %95CI: 0.49-0.99) olduğu bildirilmiştir. Molnupiravir alan grupta 1 hasta kaybedilirken, plasebo alan grupta 9 hastanın hayatını kaybettiği; 3. ve 5.gündeki viral klirens oranlarının molnupiravir grubunda belirgin olarak daha yüksek olduğu ve istenmeyen ve ciddi istenmeyen etkilerin gruplar arasında benzer olduğu duyurulmuştur (9, 10).
11 Ekim 2021 tarihinde ilgili firma FDA’ya molnupiravirin COVID-19 tedavisinde kullanım onayını almak üzere başvurmuş (11), 4 Kasım 2021 tarihinde ise İngiltere, COVID-19 tedavisinde molnupiravire kullanım onayı veren ilk ülke olmuştur (12).
19 Kasım 2021 tarihinde ise EMA uzman danışman kurulu, hafif seyirli erişkin semptomatik COVID-19 hastalarının tedavisinde, ağır hastalık açısından riskli olmaları durumunda molnupiravir kullanımını tavsiye etmiştir (13).
1 Aralık 2021 tarihinde de FDA uzman danışma kurulu, molnupiravirin yine hafif seyirli ve riskli semptomatik COVID-19 hastaları için kullanılmasını tavsiye etmiştir (14).
Üretici firma Hindistan’da 8 firmaya, düşük ve orta düşük gelirli ülkelerde kullanılmak üzere jenerik molnupiravir üretimi için izin vermiştir. Böylece yoksul ülkeler için, ABD’de $712 olan 5 günlük tedavi maliyetinin, $10’a kadar düşürülebileceği beklenmektedir (15) .
Ülkemizden de merkezlerin dahil olduğu molnupiravirin temaslı kişilerde profilaksi amacıyla kullanımının araştırıldığı Faz-III çalışma ise Ekim 2021’de başlamış olup halen devam etmektedir.
Molnupiravirin ara ürünlerinin DNA sentezinde kullanılabileceğine dair Zhou ve ark. tarafından yapılan bir in-vitro çalışmanın yayımlanmasının ardından, bu ajanın insan hücrelerinde de mutasyonu tetikleyebileceği yönünde kuşkular ortaya çıkmıştır (16). Ancak ilgili firma, genotoksisite analizlerinin detaylı bir şekilde ve uygun yöntemlerle yapıldığını, preklinik in-vivo hayvan mutajenisite çalışmalarında (Pig-a mutagenicity assay and Big Blue [cII locus] transgenic rodent assay) sorun belirlenmediğini bildirmiş, Zhou ve ark.’nın çalışmasında kullanılan yöntemlerin uygun olmadığını ifade ederek bulgulara itiraz etmiştir (17). FDA danışma kurulu da firmanın yaptığı genotoksisite çalışmalarının yeterli olduğunu bildirmiştir (10).
Molnupiravirle ilişkili bir diğer kaygıysa, molnupiravir gibi mutajenik antivirallerin virusta mutasyonu uyarmasının bir sonucu olarak yeni ve daha tehlikeli olabilecek varyantların ortaya çıkmasına yol açabileceği konusundaki hipotezlerdir. Bu hipotezi ileri sürenler, olası mutant bir virusun başkalarına bulaşmaması için molnupiravir kullanan kişilerin izolasyonunun önemine vurgu yapmaktadır (18). Ancak molnupiravirin virusta neden olduğu yoğun mutasyon, virus için sıklıkla kısa sürede ölümcül olduğundan bu kaygının klinik önemi henüz bilinmemektedir.
Öneri
COVID-19 ülkemizde halen her gün yüzlerce ölüme yol açmaktadır. Hastalığın erken tedavisinde kullanılabilecek, daha etkili başka bir oral antiviral bulunmamaktadır. Bu nedenle, ayaktan izlenen veya başka nedenlerle hastanede yatarken COVID-19 tanısı konulup, semptomlarının ilk 5 gününde olan hafif-orta şiddetli COVID-19 olgularında, ağır COVID-19 için en az 1 risk faktörü bulunması halinde molnupiravirin kullanılması uygun olacaktır.
Molnupiravirin kullanım dozu ve süresi; 2X800mg/gün, toplam 5 gün şeklindedir.
Kaynaklar
- Pruijssers AJ, Denison MR. Nucleoside analogues for the treatment of coronavirus infections. Current Opinion in Virololgy 2019;35:57-62. doi: 10.1016/j.coviro.2019.04.002.
- Sheahan TP, Sims AC, Zhou S, Graham RL, Pruijssers AJ, et al. An orally bioavailable broad-spectrum antiviral inhibits SARS-CoV-2 in human airway epithelial cell cultures and multiple coronaviruses in mice. Science Translational Medicine 2020;12(541):eabb5883. doi: 10.1126/scitranslmed.abb5883
- Cox RM, Wolf JD, Plemper RK. Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets. Nature Microbiology 2021 ;6(1):11-18. doi: 10.1038/s41564-020-00835-2.
- Painter WP, Holman W, Bush JA, Almazedi F, Malik H, et al. Human Safety, Tolerability, and Pharmacokinetics of a Novel Broad-Spectrum Oral Antiviral Compound, Molnupiravir, with Activity Against SARS-CoV-2. medRxiv preprint 2020; doi: https://doi.org/10.1101/2020.12.10.20235747 [accessed 16 June 2021].
- https://www.businesswire.com/news/home/20210415005258/en/
- https://www.heteroworld.com/images/Press_Release_Molnupiravir_Interim_Clinical_Results_Final_090721.pdf
- Willyard C. Nature 2021; https://doi.org/10.1038/d41586-021-02783-1
- https://www.merck.com/news/merck-and-ridgebacks-investigational-oral-antiviral-molnupiravir-reduced-the-risk-of-hospitalization-or-death-by-approximately-50-percent-compared-to-placebo-for-patients-with-mild-or-moderat/
- https://www.merck.com/news/merck-and-ridgeback-biotherapeutics-provide-update-on-results-from-move-out-study-of-molnupiravir-an-investigational-oral-antiviral-medicine-in-at-risk-adults-with-mild-to-moderate-covid-19
- https://www.fda.gov/media/154419/download
- https://www.merck.com/news/merck-and-ridgeback-announce-submission-of-emergency-use-authorization-application-to-the-u-s-fda-for-molnupiravir-an-investigational-oral-antiviral-medicine-for-the-treatment-of-mild-to-moderate-c/
- https://www.gov.uk/government/news/first-oral-antiviral-for-covid-19-lagevrio-molnupiravir-approved-by-mhra#:~:text=and%20licensing%20guidance-,First%20oral%20antiviral%20for%20COVID%2D19%2C%20Lagevrio%20(molnupiravir),review%20of%20the%20available%20evidence
- https://www.ema.europa.eu/en/news/ema-issues-advice-use-lagevrio-molnupiravir-treatment-covid-19
- https://www.cnbc.com/2021/11/30/fda-advisory-panel-narrowly-endorses-mercks-oral-covid-treatment-pill-despite-reduced-efficacy.html
- https://www.nytimes.com/2021/10/17/health/covid-treatment-access-molnupiravir.html.
- Zhou S. The Journal of Infectious Diseases® 2021;224:415–9.
- Troth S. The Journal of Infectious Diseases, jiab362, https://doi.org/10.1093/infdis/jiab362
- https://virological.org/t/mutagenic-antivirals-the-evolutionary-risk-of-low-doses/768
- Jayk Bernal A, Gomes da Silva MM, Musungaie DB, et al. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. N Engl J Med. 2021 Dec 16. doi: 10.1056/NEJMoa2116044. Epub ahead of print. PMID: 34914868.
Pakslovid (PF-07321332+ritonavir)
PF-00835321 ve onun yeni tasarlanmış fosfat ön ilacı olan PF-07304814, koronavirusların ana proteazına (Mpro) karşı, insan proteazlarından daha fazla olmak üzere in-vitro potent inhibitör etki göstermektedir. İlk kez 2003 yılında SARS için geliştirilmiş olan bu ilaçla ilgili çalışmalar, SARS salgınının sonlanmasıyla klinik kullanıma uygun hale getirilemeden sonlandırılmıştır. COVID-19’un ortaya çıkması, ve SARS-CoV-2 Mpro proteinin SARS ile neredeyse aynı olduğunun anlaşılması üzerine, bu ajanın COVID-19’da kullanılabileceği düşünülerek çalışmalar başlatılmıştır. Klinik öncesi çalışmalarda PF-00835231’in SARS-CoV-2’ye karşı da in vitro potent antiviral etkinliği ve farmasötik özelliklerinin uygun olduğu görülmüştür.
İV olarak uygulanabilen PF07304814’ün oral formu PF07321332 adıyla geliştirilmiştir. PF-07321332’nin oral biyoyararlanımının iyi olması, COVID-19’un klinik yönetimi için oldukça avantajlıdır (1, 2, 3). PF-07304814 (IV) ve PF-07321332 (oral)’nin klinik çalışmalarının bir kısmı tamamlanmış, bir kısmı ise devam etmektedir. Oral form olan PF-07321332 klinik çalışmalarda ritonavirle birlikte kullanılmış olup, bu kombinasyona pakslovid adı verilmiştir. Faz-2-3 çalışmasının basınla paylaşılan ara analiz sonuçlarında, ağır hastalık açısından riskli, semptomlarının ilk 3-5 gününde olan 1219 erişkin COVID-19 hastasında, pakslovidin hastane yatışı ve ölüm riskini 89% azalttığı bildirilmiştir (4, 5). Bu verilerle ilacın yararı gösterildiği için, bağımsız değerlendirme komisyonu ve FDA çalışmanın sonlandırılmasını önermiş ve ilgili firma FDA’ye acil kullanım onayı için başvurmuştur. Molnupiravirde olduğu gibi pakslovid içinde ilgili firma, düşük ve orta düşük gelirli ülkelerde patent hakkından vazgeçtiğini duyurmuştur.
Öneri
Pakslovid, Faz-3 çalışmasında COVID-19’a karşı yüksek etkinlik göstermiş veCOVID-19’da kullanılmak üzere FDA’dan acil kullanım onayı almıştır. Bu nedenle, ayaktan izlenen veya başka nedenlerle hastanede yatarken COVID-19 tanısıkonulup, semptomlarının ilk 5 gününde olan hafif-orta şiddetli COVID-19 olgularında, ağır COVID-19 için en az 1 risk faktörü bulunması halinde molnupiravirin kullanılması uygun olacaktır.
Kaynaklar
- Hoffman RL, Kania RS, Brothers MA, Davies JF, Ferre RA et al. Discovery of ketone-based covalent inhibitors of coronavirus 3CL proteases for the potential therapeutic treatment of COVID-19J. Journal of Medical Chemistry 2020; 63(21): 12725–12747 doi: 10.1021/acs.jmedchem.0c01063
- Boras B, Jones RM, Anson BJ, Arenson D, Aschenbrenner L, et al. Discovery of a novel inhibitor of coronavirus 3CL protease as a clinical candidate for the potential treatment of COVID-19. bioRxiv [Preprint]. 2020:2020.09.12.293498. doi: 10.1101/2020.09.12.293498; [accessed 16 June 2021].
- Dolgin E. The race for antiviral drugs to beat COVID – and the next pandemic. Nature 2021;592(7854):340-343. doi: 10.1038/ d41586-021-00958-4
- Mahase E. Covid-19: Pfizer’s paxlovid is 89% effective in patients at risk of serious illness, company reports . BMJ2021; 375:n2713. doi: https://doi.org/10.1136/bmj.n2713
- https://www.pfizer.com/news/press-release/press-release-detail/pfizer-provide-us-government-10-million-treatment-courses
- Coronavirus (COVID-19) Update: FDA Authorizes First Oral Antiviral for Treatment of COVID-19. https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-first-oral-antiviral-treatment-covid-19n
![]()

